Zellkerntransfer
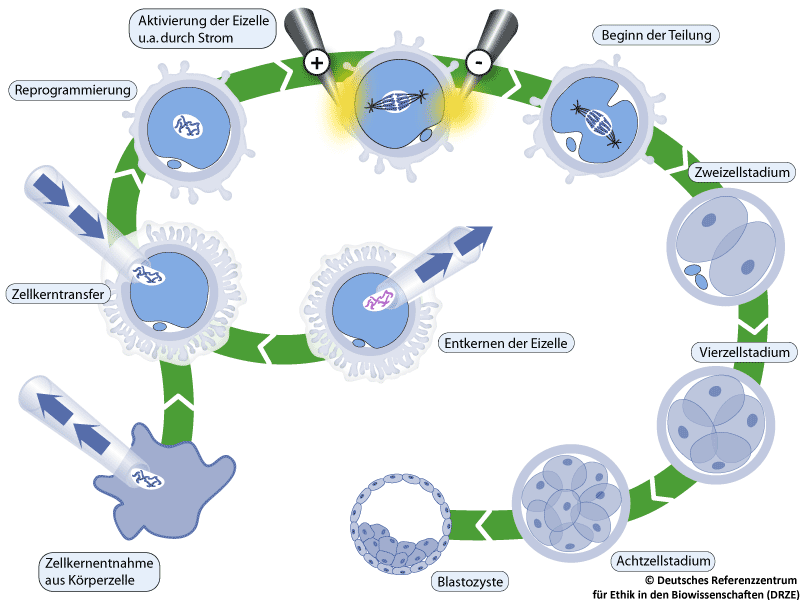
Für das Verfahren des somatischen Zellkerntransfers (engl. somatic cell nuclear transfer [SCNT]) wird zum einen ein Zellkern, zum anderen eine Eizelle ohne eigenen Zellkern benötigt. Die Eizelle wird durch einen minimalinvasiven Eingriff nach einer oft für die spendende Person körperlich belastenden Hormonbehandlung aus den Eierstöcken gewonnen und entkernt. Der Zellkern aus einer Körperzelle wird abgesaugt und in das Zytoplasma der entkernten Eizelle injiziert. Der Zellkern kann dabei praktisch aus jeder adulten Körperzelle der spendenden Person isoliert werden. Danach kommt es zur Reprogrammierung, einem noch weitgehend unverstandenen Prozess, bei dem die DNA des eingebrachten Zellkerns ihre Spezialisierung verliert. Dies erfolgt über sogenannte epigenetische Veränderungen: Gensequenzen der DNA, die im Verlauf ihrer Spezialisierung „verpackt” und nicht mehr abgelesen wurden, werden mittels sogenannter Transkriptionsfaktoren wieder aktiviert und abgelesen. Diese Veränderungen sind eine Voraussetzung für die weitere Entwicklung der neu zusammengesetzten Zelle. Nach ihrer Aktivierung durch Strom und verschiedene Mediumzusätze beginnt sich die Eizelle mit dem Körperzellkern in einem Nährmedium zu teilen und kann sich unter gegebenen Umständen bis zur Blastozyste oder noch weiter entwickeln (siehe Abbildung). Aus der Blastozyste können anschließend embryonale Stammzellen gewonnen werden (siehe Abbildung 3).
Die Effizienz der Technik ist insgesamt begrenzt, ihre Verbesserung ist Gegenstand von Forschungsvorhaben. Mehr Informationen hierzu werden in dem Modul Forschung zum Zellkerntransfer dargestellt.
Das Verfahren der Hervorbringung von Säugetier-Embryonen durch die Übertragung des Zellkerns einer adulten Körperzelle auf eine entkernte Eizelle wurde 1997 durch Ian Wilmut et al. erstmals beschrieben, die es bei der Herstellung des Klonschafs Dolly einsetzten. Seither wurde die Methode erfolgreich auch bei anderen Säugetierarten durchgeführt; so berichteten zum Beispiel im Jahre 1998 Teruhiko Wakayama et al. über den erfolgreichen Einsatz einer ähnlichen Technik bei der Maus. Die Methode des reproduktiven Klonens ist insgesamt allerdings mit hohen Missbildungs- und Sterblichkeitsraten verbunden.
Siehe weiterführend:
Wakayama, T., Perry, A. C. F., Zuccotti, M., Johnson, K. R., & Yanagimachi, R. (1998). Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature, 394, 369–373. https://doi.org/10.1038/28615
Wilmut, I., Schnieke, A. E., McWhir, J., Kind, A. J., & Campbell, K. H. S. (1997). Viable offspring derived from fetal and adult mammalian cells. Nature, 385, 810–813. https://doi.org/10.1038/385810a0